Xem xét đưa thuốc Remdesivir vào phác đồ điều trị cho bệnh nhân Covid-19
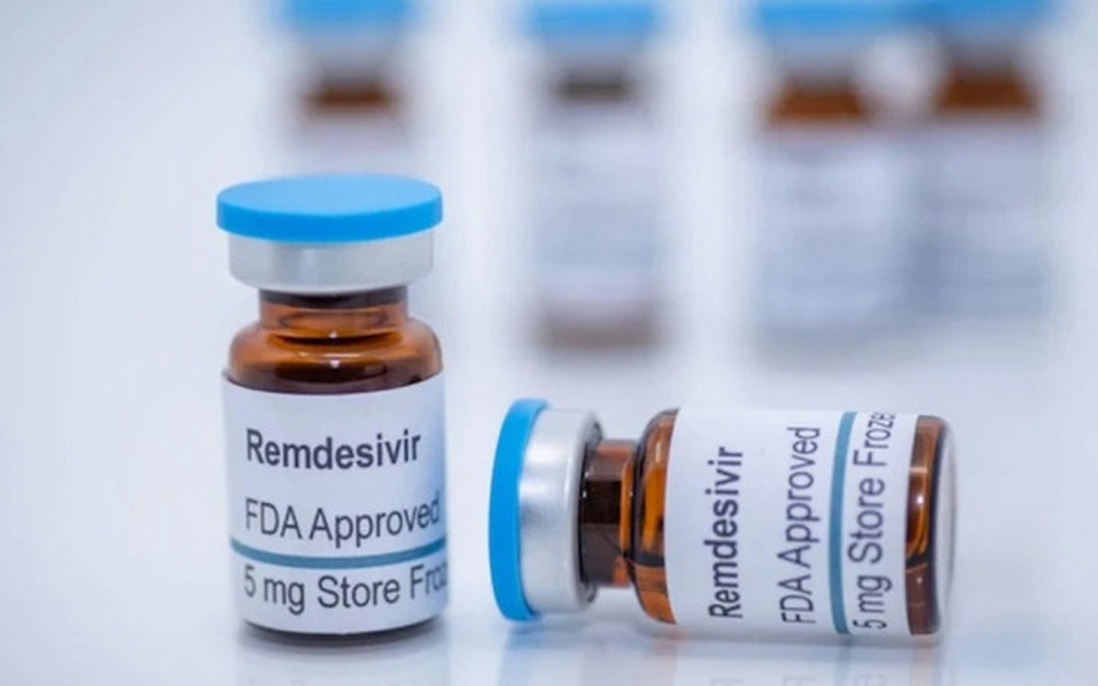
Thuốc Remdesivir đã được FDA phê chuẩn dùng cho điều trị bệnh nhân Covid-19
Hội đồng chuyên môn Bộ Y tế đã họp và xem xét đưa nhiều loại thuốc vào phác đồ điều trị Covid-19, trong đó có Remdesivir.
Chiều 6/8, Hội đồng Chuyên môn của Bộ Y tế đã tổ chức họp trực tuyến về cập nhật hướng dẫn chẩn đoán và điều trị Covid-19.
Tại cuộc họp, PGS.TS Lương Ngọc Khuê, Cục trưởng Cục quản lý Khám chữa bệnh (Bộ Y tế) cho biết, trong thời gian qua, hướng dẫn chuyên môn của Bộ Y tế đã phát huy hiệu quả trong chăm sóc, điều trị bệnh nhân Covid-19. Trên thế giới, khi có hướng dẫn chẩn đoán mới về điều trị Covid-19, Bộ đều cập nhật. Bởi đây là việc làm cần thiết để đáp ứng tình hình điều trị và công tác chống dịch Covid-19.
Cũng trong cuộc họp, các thành viên Hội đồng đã thảo luận về các thuốc điều trị hiện nay, như thuốc điều trị rối loạn đông máu thêm loại đường uống, thuốc kháng virus, thuốc kháng thể đơn dòng, thuốc diệt ký sinh trùng, liệu pháp nằm sấp…. Trong đó có Remdesivir.
Theo Bộ Y tế, Remdesivir là thuốc đã được cấp phép khẩn cấp tại Ấn Độ cho chỉ định điều trị Covid-19 cho bệnh nhân nặng, thở máy/ECMO.
Remdesivir là thuốc kháng virus được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt khẩn cấp để điều trị cho bệnh nhân Covid-19. Hiện Remdesivir đã được 50 quốc gia như Mỹ, EU, Úc, Nhật Bản, Singapore, Ấn Độ... đưa vào phác đồ điều trị từ tháng 5/2020 và là một trong những loại thuốc đặc trị khó tiếp cận hàng đầu thế giới.
Trước đó, ngày 5/8, lô thuốc Remdesivir điều trị Covid-19 đầu tiên với khoảng 50.000 lọ đã về Việt Nam. Số thuốc này do Tập đoàn Vingroup đàm phán thành công đơn hàng đặc biệt gồm 500.000 lọ thuốc Remdesivir được FDA Mỹ cấp phép. Dự kiến, trong tháng 8/2021, toàn bộ lô thuốc trên sẽ được đưa về Việt Nam.
Ngay khi số lô thuốc này về Việt Nam, Bộ Y tế sẽ phân bổ cho các tỉnh, thành phố đang có dịch Covid-19.