TAG cục quản lý dược

Kiểm soát chặt chẽ mỹ phẩm dùng cho trẻ em, phụ nữ mang thai
Sức khỏe 23:41 26/01/2026Bộ Y tế đang sửa đổi cơ chế quản lý mỹ phẩm theo hướng phân loại rủi ro, tăng hậu kiểm và siết trách nhiệm toàn chuỗi, nhằm chấn chỉnh tình trạng mỹ phẩm kém chất lượng, quảng cáo sai công dụng, đặc biệt là với nhóm mỹ phẩm dùng cho trẻ em, phụ nữ mang thai.

Quản lý mỹ phẩm: Cơ sở sản xuất và nhập khẩu chịu trách nhiệm liên đới khi sản phẩm có vấn đề
Sức khỏe 14:15 22/01/2026Dự thảo Nghị định sửa đổi về quản lý mỹ phẩm đang được Bộ Y tế lấy ý kiến quy định nhà công bố sản phẩm phải chịu trách nhiệm chính về chất lượng mỹ phẩm lưu hành, còn cơ sở sản xuất và nhập khẩu chịu trách nhiệm liên đới. Đây được xem là điểm nhấn quan trọng nhằm khắc phục tình trạng né tránh trách nhiệm, siết chặt quản lý thị trường mỹ phẩm.

Bộ Y tế đề nghị lấy mẫu kiểm nghiệm nhiều loại mỹ phẩm do Mailisa kinh doanh
Sức khỏe 15:07 18/11/2025Cục Quản lý Dược (Bộ Y tế) vừa có công văn gửi sở y tế các tỉnh, thành trên cả nước đề nghị lấy mẫu các sản phẩm mỹ phẩm các nhãn hàng Doctor Magic, Maika Beauty, MK.

Cục Quản lý Dược: Không có thuốc chứa Phenylbutazone được phép lưu hành tại Việt Nam
Sức khỏe 09:26 12/10/2025Cục Quản lý Dược, Bộ Y tế, khẳng định, không có thuốc chứa Phenylbutazone được phép lưu hành tại Việt Nam và yêu cầu siết chặt kiểm soát quảng cáo, kinh doanh sản phẩm y tế trên mạng xã hội.

Bộ Y tế "nới" phân cấp 32 nhiệm vụ và thủ tục hành chính lĩnh vực dược
Sức khỏe 14:36 26/09/2025Bộ Y tế đã phân cấp 32 thủ tục liên quan đến lĩnh vực dược phẩm, giúp rút ngắn thời gian, nâng cao hiệu quả quản lý và chủ động xử lý hồ sơ.
Tử vong vì sử dụng thuốc mua online, không rõ nguồn gốc xuất xứ
Phòng & chữa bệnh 12:25 31/08/2025Chỉ trong thời gian ngắn, Trung tâm Dị ứng và Miễn dịch lâm sàng, Bệnh viện Bạch Mai (Hà Nội) đã tiếp nhận 4 bệnh nhân bị dị ứng thuốc sau khi sử dụng Phenylbutazone mua online, không rõ nguồn gốc xuất xứ. Đáng chú ý, 1 bệnh nhân đã tử vong do biến chứng nguy hiểm liên quan đến loại thuốc này.
Bệnh nhân nhập viện do mỹ phẩm không rõ nguồn gốc ngày càng tăng
Phòng & chữa bệnh 19:57 25/08/2025Dù biết rõ sử dụng các mỹ phẩm không rõ xuất xứ, nguồn gốc có thể gây ra những hậu họa khôn lường cho sức khỏe, tuy nhiên, với tâm lý ham rẻ, nhiều người tiêu dùng vẫn bất chấp các nguy cơ, tìm mua các mỹ phẩm trôi nổi trên thị trường... Chính tâm lý này là một trong những hành vi tiếp tay cho vấn nạn mỹ phẩm giả tràn lan.

Bộ Y tế cấp mới, gia hạn giấy đăng ký lưu hành gần 800 loại thuốc
Phòng & chữa bệnh 10:17 22/08/2025Cục Quản lý Dược vừa cấp mới, gia hạn gần 800 loại thuốc, nguyên liệu làm thuốc trong và ngoài nước để đáp ứng nhu cầu điều trị, phòng chống dịch bệnh.

Bộ Y tế yêu cầu tiêu hủy lô sữa rửa mặt hạt mơ Episode BM Beaumore
Phòng & chữa bệnh 15:33 21/08/2025Bộ Y tế thông báo thu hồi lô sản phẩm sữa rửa mặt hạt mơ Episode BM Beaumore do cơ quan kiểm nghiệm phát hiện có 2 chất không được công bố trong thành phần công thức sản phẩm.
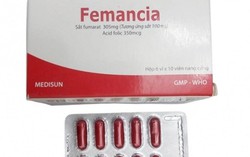
Bộ Y tế cấm sản xuất, lưu hành loại thuốc Femancia điều trị thiếu máu
Phòng & chữa bệnh 11:50 18/07/2025Cục Quản lý Dược yêu cầu Công ty cổ phần dược phẩm Me Di Sun phối hợp với nhà phân phối thuốc, có trách nhiệm tổ chức việc thu hồi và thu hồi toàn bộ thuốc Femancia.
